В тех случаях, когда создавалось впечатление, что в последовательности изменения свойств элементов не хватает какого-нибудь звена, в Периодической таблице предусматривались ПРОБЕЛЫ, которые надо было заполнить еще не открытыми элементами. Мало того, Периодический закон позволял ПРЕДСКАЗЫВАТЬ свойства этих элементов.
Открытый закон периодичности Д. И. Менделеев использовал для создания периодической системы элементов. «Днем рождения» системы Д. И. Менделеева обычно считают 18 февраля 1869 г., когда был составлен первый вариант таблицы. В этой таблице 63 известных Д. И. Менделееву элемента были расположены в порядке возрастания атомных масс. Это расположение отражало также периодичность изменения свойств элементов. В таблице были оставлены пустые места для четырех еще не открытых элементов с атомными массами 45, 68, 70 и 180. Существование их было предсказано Д. И. Менделеевым.
Закон периодичности и периодическая система элементов сыграли важную конструктивную роль при проверке и уточнении свойств многих элементов. Однако настоящий триумф периодической системы Д. И. Менделеева был связан с открытием предсказанных им элементов. В 1875 г. французский химик П. Лекок де Буабодран, исследуя цинковые руды методами спектрального анализа, обнаружил следы неизвестного элемента. Открытие этого элемента, названного галлием, быть может, прошло бы незаметным, если бы некоторое время спустя автор не получил письмо от русского ученого, в котором утверждалось, что плотность нового элемента должна быть равна не 4,7 г/см3, как сообщал П. Лекок де Буабодран, а 5,9 г/см3. Повторные измерения плотности очищенного от примеси галлия дали значение 5,904 г/см3.
Предсказывая свойства неизвестных элементов, Д. И. Менделеев использовал вытекавшее из периодического закона правило звездности, в соответствии с которым свойства любого химического элемента, например, Mg, находятся в закономерной связи со свойствами соседних элементов, расположенных по горизонтали (Na, Al), вертикали (Be, Ca) и диагонали (Li, Sc и K, B).

Спустя несколько лет шведский ученый Л. Нильсон открыл предсказанный Д.И. Менделеевым экабор, назвав его скандием. Наконец, в 1886 г. немецкий химик К. Винклер открыл новы элемент – германий, свойства которого полностью совпали со свойствами, указанными Д. И. Менделеевым для экасицилия. После этого периодический закон получил всемирное признание, а периодическая система стала неотъемлимой частью любого учебника по химии.
Периодический закон – величайшее достижение химической науки, основа всей современной химии. С его открытием химия перестала быть описательной наукой, в ней стало возможным научное предвидение.
Первый вариант Периодической таблицы элементов был опубликован Дмитрием Ивановичем Менделеевым в 1869 году - задолго до того, как было изучено строение атома.
Более детальное изучение строения вещества показало, что периодичность свойств элементов обусловлена не атомной массой, а электронным строением атомов.
Заряд ядра является характеристикой, определяющей электронное строение атомов, а следовательно, и свойства элементов. Поэтому в современной формулировке Периодический закон звучит так:
свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от порядкового номера (от величины заряда ядра их атомов).
Выражением Периодического закона является периодическая система элементов.
Строение атома
Атом — это наименьшая химически неделимая частица, входящая в состав молекул простых и сложных веществ.
В свою очередь, атом состоит из более мелких частиц – протонов, нейтронов и электронов.
Английский физик Дж. Дж. Томсон предположил, что атом представляет собой некую субстанцию, в которой равномерно распределены протоны, нейтроны и электроны. Число протонов равно числу электронов, поэтому атом в целом электронейтрален. Эту модель строения атома Томсона образно называют «сливовый пудинг», булочка с изюмом (где «изюминки» – это электроны), или «арбуз» с «семечками» – электронами.

| Частица | Обозначение | Заряд | Относительная атомная масса |
| Протон | p+ | + | 1 |
| Нейтрон | n0 | 0 | 1 |
| Электрон | e - | – | 1/1840 |
Однако от этой модели отказались, т. к. были получены экспериментальные данные, противоречащие ей.
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро, в котором сконцентрирована основная масса атома, поскольку ядро содержит протоны и нейтроны; вокруг ядра, подобно планетам вокруг Солнца, на огромной скорости вращаются электроны, так называемая планетарная модель строения атома Резерфорда. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.



Характеристика атома
1. Атом состоит из ядра и электронной оболочки. Ядро состоит из протонов и нейтронов, а электронная оболочка – из электронов. Радиус ядра примерно в 100000 раз меньше радиуса атома.
2. Так как масса электрона незначительна по сравнению с массами протона и нейтрона, то ею можно пренебречь, то есть масса атома (называется массовым числом) сосредоточена в ядре:

 m ат= mp + mn + me
m ат= mp + mn + me
3. Ядро заряжено за счёт протонов.
4. Электроны заряжено отрицательно, вращаются вокруг ядра и вокруг своей оси по «часовой стрелки» или против «часовой стрелки». Движение электрона вокруг своей оси называется «спин».
5. Число протонов равно числу электронов, поэтому атом будет электронейтрален. Атом из периодической таблицы – всегда электронейтрален.
6. Число протонов соответствует порядковому номеру элемента в таблице ПСХЭ (Периодической системе химических элементов).
7. Число нейтронов: nn = m ат – np (масса атома минус число протонов).
 Fe 26
Железо Fe 26
Железо
 55,8 55,8
|
Порядковый номер
Относительная масса
5626Fe (26р+; 30n0) 26e-
При изменении числа протонов образуется другой химический элемент.
Химический элемент – это вид атома с одинаковым числом протонов, т.е. с одинаковым зарядом ядра.
При изменении числа нейтронов элемент не изменяется, а изменяется его масса и образуется изотоп.
Изотопы – это разновидности атома данного химического элемента, различающиеся массой атома, т.е атомы с одинаковым числом протонов, но разным числом нейтронов.
Например, элемент водород имеет три изотопа: протий (11H), дейтерий (12H) и тритий (13H). Первые два существуют в природе, тритий получен искусственным путем. Подавляющее большинство химических элементов имеет разное число природных изотопов с разным процентным содержанием каждого из них.
Относительная атомная масса элемента, которая приводится в периодической системе, – это средняя величина массовых чисел природных изотопов данного элемента с учетом процентного содержания каждого из этих изотопов. Химические свойства всех изотопов одного химического элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
При изменении числа электронов ни элемент, ни его масса не изменяется, а изменяется заряд атома и образуются ионы.
Ионы – это заряженные разновидности атомов данного химического элемента, у которых одинаковое число протонов, но разное число электронов.
 |
Задача.
 Что получим, если в цинке +1p+, -3n0, -2e-?
Что получим, если в цинке +1p+, -3n0, -2e-?
| 6530Zn0 | 30 p+ 35 n0 30 e- | +1p+ -3n0 -2e- | 31 p+ 32 n0 28 e- | 63 31 Ga+3 | 6931Ga0 |
Катион изотопа галлия
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель позволяет объяснить многие экспериментальные факты, например, почему при химических реакциях тепло или выделяется, или поглощается – из-за перехода электрона с уровня на уровень. Данная модель строения атома получила названия «модель Бора».

Квантовая механика представила более современную модель строения атома.
В настоящее время согласно современным квантово-механическим представлениям электроны обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом (электрон одновременно – это и частица, и волна) и при вращении образуют различной формы электронные облака.
Движение электрона в атоме.
Согласно квантовой механике, область пространства в электронном облаке, в которой вероятность нахождения электрона наибольшая, называется орбиталью .
Формы электронных облаков:

f-орбиталь имеет более сложную форму.
1. s-форма электронного облака (s – «sharp» - резкая, отчётливая) (s-орбиталь) – «шарообразного» вида.
2. p форма электронного облака (p – «principal» - главная) (p-орбиталь) – вида «объёмной симметричной восьмерки».
3. d-форма электронного облака (d – «diffuse» - диффузная, размытая) (d-орбиталь) – вида «простого цветка».
4. f-форма электронного облака (f – «fundamental» - основная) (f-орбиталь) – вида «сложного цветка».
Принцип Паули.
В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Поэтому на каждой орбитали может находиться не более двух электронов (у которых главное, орбитальное и магнитное квантовые числа одинаковы), но обязательно с противоположными спинами. Используя этот принцип, можно подсчитать максимальное число электронных состояний N, соответствующих различным значениям главного квантового числа п: N = 2п2.
3. Правило Гунда (или Хунда).
Электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарное спиновое число их было максимальным.
Таким образом, наиболее устойчивому состоянию атома соответствует максимально возможное число неспаренных электронов с одинаковыми спинами. Например, на р-подуровне 3 электрона будут занимать орбитали так
| ↑ | ↑ | ↑ | , но не так | ↑↓ | ↑ | и не так | ↑ | ↓ | ↑ |
(+1/2)+(-1/2)+(+1/2)= (+1/2)+(-1/2)+(+1/2)= (+1/2)+(-1/2)+(+1/2)=
=(+3/2) =(+1/2) = (+1/2)
В этой записи каждая электронная орбиталь обозначена клеткой (квантовой ячейкой), а электрон — стрелкой, направление которой соответствует направлению спина.
Например, электронные формулы магния, железа и теллура имеют вид:
Mg(+12) 1s22s22p63s2;
Fe(+26) 1s22s22p63s23p64s23d6;
Te(+52) 1s22s22p63s23p64s23d104p65s24d105p4.
Исключения в четвертом периоде составляют атомы хрома и меди, в которых происходит проскок (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10. Таким образом, электронные формулы атомов хрома и меди имеют вид:
Cr(+24) 1s22s22p63s23p64s13d5, а не Cr(+24) 1s22s22p63s23p64s23d4;
Cu(+29) 1s22s22p63s23p64s13d10, а не Cu(+29) 1s22s22p63s23p64s23d9.
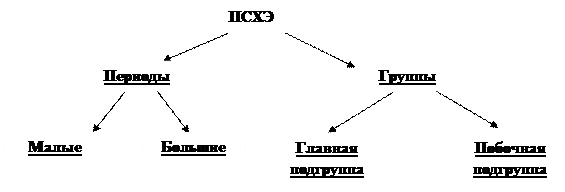
Структура ПСХЭ Д. И. Менделеева
 3Li 1s2 2s1
3Li 1s2 2s1
4Be 1s2 2s2
5B 1s2 2s2 2p1
6C 1s2 2s2 2p2
7N 1s2 2s2 2p3
Периоды ПСХЭ – это отдельные горизонтальные ряды, объединяющие элементы, у которых одинаковое число внутренних энергетических уровней, но разное число электронов на внешнем энергетическом уровне.
1H 1s1
3Li 1s2 2s1
11Na 1s2 2s2 2p6 3s1
19K 1s2 2s2 2p6 3s2 3p6 4s1
37Rb 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Группы ПСХЭ – это отдельные вертикальные столбцы, объединяющие элементы, у которых разное число внутренних энергетических уровней, но одинаковое число электронов на внешнем энергетическом уровне.
Внешний энергетический уровень образуется только s - или s- и p - подуровнями.
Номер периода соответствует номеру энергетического уровня (по s - и p - подуровням).
Число электронов на внешнем энергетическом уровне для элементов s - и p - подуровней соответствует номеру группы.
Количество электронов на внешнем уровне элементов у d - и f - подуровней равно от 0 до 2 электронов (смотри ПСХЭ).
Структура ПСХЭД.И. Менделеева (Изменение свойств в периодах и группах).
Свойства элементов в периодах и группах изменяются периодически:
Радиус
 |
Электроотрицательность
 |
Металличность
 |
Неметалличность
 |
Энергия ионизации
 |
Сродство к электрону
 |
Обозначение:
 - увеличение
- увеличение
Электроотрицательность – свойство атомов данного химического элемента в соединениях притягивать к себе электроны, участвующие в образовании химической связи (валентные электроны), или свойство атомов данного химического элемента оттягивать на себя электроны от атомов других элементов в соединениях.
Металличность – это способность атома химического элемента отдавать электроны со своего энергетического уровня.
Неметалличность – это способность атома химического элемента отбирать электроны с энергетического уровня другого химического элемента.
Энергия ионизации – это энергия, затрачиваемая для отрыва электрона от атома и превращения последнего в соответствующий ион.
Сродство к электрону – это количество энергии выделяющееся при присоединении электрона к атому, молекуле или радикалу.
Характеристики химических элементов и их соединений закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера, т.е. слева и направо):
· увеличивается заряд ядра,
· увеличивается число внешних электронов,
· уменьшается радиус атомов,
· увеличивается прочность связи электронов с ядром (энергия ионизации),
· увеличивается электроотрицательность,
· усиливаются окислительные свойства простых веществ ("неметалличность"),
· ослабевают восстановительные свойства простых веществ ("металличность"),
· ослабевает основный характер гидроксидов и соответствующих оксидов,
· возрастает кислотный характер гидроксидов и соответствующих оксидов,
· валентность в соединении с кислородом возрастает от 1 до 7, высшая валентность равна номеру группы.
В группах (с увеличением порядкового номера, т.е. сверху вниз):
· увеличивается заряд ядра,
· увеличивается радиус атомов (только в главных подгруппах),
· уменьшается прочность связи электронов с ядром (энергия ионизации; только в главных подгруппах),
· уменьшается электроотрицательность (только в главных подгруппах),
· ослабевают окислительные свойства простых веществ ("неметалличность"; только в главных подгруппах),
· усиливаются восстановительные свойства простых веществ ("металличность"; только в главных подгруппах),
· возрастает основный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· снижается устойчивость водородных соединений (повышается их восстановительная активность; только в главных подгруппах),
· валентность элементов не изменяется и равна номеру группы.
Самый активный металл Fr – легче всего отдает свои электроны с внешнего энергетического уровня. (Самый большой радиус атома в периоде и группе –у него только один электрон на внешнем энергетическом уровне, поэтому электрон притягивает к ядру очень слабо).
Самый активный неметалл F – легче всего притягивает электроны от атомов других элементов (очень маленький радиус атома в периоде и группе, и у него 7 электронов на внешнем энергетическом уровне, т.е. до 8 не хватает только 1 электрона, поэтому электроны притягиваются к ядру очень сильно и расстояние от ядра до внешнего энергетического уровня другого химического элемента очень небольшое).
В соединениях атомы химических элементов стремятся иметь наибольшее энергетически выгодное состояние: на внешнем энергетическом уровне должно быть или 8 электронов (полное заполнение электронами s- и p-подуровней) или 0 электронов (полное отсутствие электронов на s- и p-подуровне). Исключение составляет только первый период – там только один подуровень, а значит и максимальное число электронов – 2 электрона.
Все химические элементы в ПСХЭ можно разделить на две группы: металлы и неметаллы (по химическим и физическим свойствам), но среди металлов есть химические элементы, которые в соединениях с другими химическими элементами могут проявлять и некоторые свойства неметаллов.
Элементы
 |  |  | |||
Металлы Амфотерные элементы Неметаллы
(порядковый номер (порядковый номер (порядковый номер
- не обозначен) - обозначен полукругом) - обозначен квадратом)
Местоположение химического элемента в ПСХЭ обуславливает свойства этих элементов, и, наоборот, свойства элементов обуславливают их местоположение в ПСХЭ.
Металлы свои электроны внешнего энергетического уровня в соединениях всегда отдают. Неметаллы свои электроны внешнего уровня могут и отдавать, и принимать электроны у атомов других химических элементов (с их внешнего энергетического уровня).
d-элементы и f-элементы: все металлы;
s-элементы: кроме H и He, металлы;
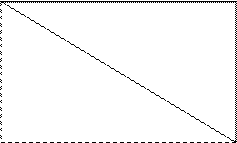
p-элементы – по «правилу треугольника»: если провести в таблице Периодической системы диагональот B до At, то – «правый верхний треугольник и сама диагональная линия» это неметаллы, а «левый нижний треугольник» – это металлы.
 |
B C N O F Ne
Cl Ar
Br Kr
I Xe
At Rn
Периодический закон Менделеева Дмитрия Ивановича. Строения атома.

К середине XIX в. – периода завершения второго химико-аналитического этапа развития химии – было открыто уже более 60 элементов, у большинства которых были изучены физические и химические свойства (некоторые из элементов к этому времени не были выделены еще в чистом виде).
Открытие новых элементов и изучение свойств элементов и их соединений, с одной стороны, позволили накопить большой фактический материал, а с другой – выявили необходимость его систематизации. Первыми попытками систематизации элементов следует, по-видимому, считать установление их общих групповых свойств. Так, наиболее резко выраженный основный характер был обнаружен у соединений элементов, названных щелочными металлами, а способность к проявлению кислотных свойств – у соединений галогенов.
В основном объединялись сходные по своим химическим свойствам элементы. Например: Li, Na, K. Или: Cl, Br, I. Эти и некоторые другие элементы объединялись в так называемые "триады". Таблица из пяти таких "триад" была опубликована Доберейнером еще в 1829 году, но она включала лишь небольшую часть из известных к тому времени элементов.
 В 1864 году англичанин Дж. Ньюлендс заметил, что если располагать элементы в порядке возрастания их атомного веса, то примерно каждый восьмой элемент является своего рода повторением первого - подобно тому, как нота "до" (как и любая другая нота) повторяется в музыкальных октавах через каждые 7 нот (закон октав). Ниже показан вариант таблицы Ньюлендса, относящийся к 1865 году. Элементы, имеющие одинаковый атомный вес (по данным того времени) помещались под одним номером. Можно видеть, с какими трудностями столкнулся Ньюлендс - наметившиеся закономерности быстро разрушались, поскольку в его системе не была учтена возможность существования еще не открытых элементов.
В 1864 году англичанин Дж. Ньюлендс заметил, что если располагать элементы в порядке возрастания их атомного веса, то примерно каждый восьмой элемент является своего рода повторением первого - подобно тому, как нота "до" (как и любая другая нота) повторяется в музыкальных октавах через каждые 7 нот (закон октав). Ниже показан вариант таблицы Ньюлендса, относящийся к 1865 году. Элементы, имеющие одинаковый атомный вес (по данным того времени) помещались под одним номером. Можно видеть, с какими трудностями столкнулся Ньюлендс - наметившиеся закономерности быстро разрушались, поскольку в его системе не была учтена возможность существования еще не открытых элементов.
 Доклад Ньюлендса «Закон октав и причины химических соотношений среди атомных весов» обсуждался на заседании Лондонского химического общества 1 марта 1866 года, а краткий отчет о нем публиковался в журнале «Сhemical News». Ньюлендс был близок к открытию Периодического закона, однако сама идея последовательной нумерации только известных к тому времени элементов не просто "ломала" плавное изменение их химических свойств - эта идея исключала возможность существования еще не открытых элементов, для которых в системе Ньюлендса просто не было места.
Доклад Ньюлендса «Закон октав и причины химических соотношений среди атомных весов» обсуждался на заседании Лондонского химического общества 1 марта 1866 года, а краткий отчет о нем публиковался в журнале «Сhemical News». Ньюлендс был близок к открытию Периодического закона, однако сама идея последовательной нумерации только известных к тому времени элементов не просто "ломала" плавное изменение их химических свойств - эта идея исключала возможность существования еще не открытых элементов, для которых в системе Ньюлендса просто не было места.
Кроме того, для многих элементов были получены количественные характеристики, определяющие их свойства. Среди них наибольший интерес представляли относительная атомная масса элементов и их валентность, т.е. способность к образованию различных форм соединений.
Ни одна из попыток классифицировать химические элементы не выявила основной закономерности в их расположении и, следовательно, не могла привести к созданию естественной системы, охватывающей все химические элементы и отражающей природу их сходства и различия. Решение этой задачи оказалось доступно лишь нашему соотечественнику Д. И. Менделееву.
Д. И. Менделеев преподавал химию в Петербургском университете. Готовясь к лекциям, собирая материал для своего учебника "Основы химии", Д. И. Менделеев раздумывал над тем, как систематизировать материал таким образом, чтобы сведения о химических свойствах элементов не выглядели набором разрозненных фактов. В этой работе Д. И. Менделеев исходил из убеждения, что в основу классификации должна быть положена фундаментальная количественная характеристика элементов – атомная масса (атомные веса) элементов, от которой «должны находиться в зависимости все остальные свойства». Но найти эту зависимость было крайне трудно по двум причинам:
1) далеко не все химические элементы были известны к началу работы Д. И. Менделеева;
2) атомные массы некоторых элементов были установлены неточно, и их формальное сопоставление приводило к недоразумениям.
После Всемирного конгресса химиков в 1860 году, в работе которого участвовал и Д. И. Менделеев, проблема правильного определения атомных весов была постоянно в центре внимания многих ведущих химиков мира, в том числе и Д. И. Менделеева.
В отличие от всех своих предшественников русский учёный сопоставил между собой несходные элементы, расположив все известные элементы в порядке возрастания атомных масс. Ниже приведены первые 14 элементов этой последовательности:

При переходе от K к F происходит закономерное ослабление металлических свойств и усиление неметаллических с одновременным увеличением валентности. Переход от фтора от F к следующему по значению атомной массы элементу натрию Na сопровождается скачкообразным изменением свойств и валентности, причем натрий во многом повторяет свойства лития, будучи типичным одновалентным металлом, хотя и более активным. Следующий за натрием магний Mg во многом сходен с бериллием Be (оба двухвалентны, проявляют металлические свойства, но химическая активность обоих выражена слабее, чем у пары Li – Na). Алюминий Al, следующий за магнием, напоминает бор B (валентность равна 3). Как близкие родственники похожи кремний Si и углерод C, фосфор P и азот N, сера S и кислород O, хлор Cl и фтор F. При переходе к следующему за хлором в последовательности увеличения атомной массы элементу калию K опять происходит скачок в изменении валентности и химических свойств. Калий, подобно литию и натрию, открывает ряд элементов (третий по счёту), представители которого показывают глубокую аналогию с элементами первых двух рядов.
Таким образом, в естественном ряду элементов (т.е. элементов, расположенных в порядке возрастания атомной массы) их химические свойства изменяются не монотонно, а периодически. Закономерное изменение свойств элементов в пределах одного отрезка естественного ряда Li – F повторяются и у других (Na – Cl, K – Br). Иначе говоря, сходные в химическом отношении элементы встречаются в естественном ряду через правильные интервалы и, следовательно, повторяются периодически. Эта замечательная закономерность, обнаруженная Д. И. Менделеевым и названная им законом периодичности, была сформулирована следующим образом:
Свойства простых тел, а также форма и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Принципиальная новизна Периодического закона, открытого и сформулированного Д. И. Менделеевым спустя ровно три года, заключалась в следующем:
1. Устанавливалась связь между НЕСХОДНЫМИ по своим свойствам элементами. Эта связь заключается в том, что свойства элементов плавно и примерно одинаково изменяются с возрастанием их атомного веса, а затем эти изменения ПЕРИОДИЧЕСКИ ПОВТОРЯЮТСЯ.
В тех случаях, когда создавалось впечатление, что в последовательности изменения свойств элементов не хватает какого-нибудь звена, в Периодической таблице предусматривались ПРОБЕЛЫ, которые надо было заполнить еще не открытыми элементами. Мало того, Периодический закон позволял ПРЕДСКАЗЫВАТЬ свойства этих элементов.
Открытый закон периодичности Д. И. Менделеев использовал для создания периодической системы элементов. «Днем рождения» системы Д. И. Менделеева обычно считают 18 февраля 1869 г., когда был составлен первый вариант таблицы. В этой таблице 63 известных Д. И. Менделееву элемента были расположены в порядке возрастания атомных масс. Это расположение отражало также периодичность изменения свойств элементов. В таблице были оставлены пустые места для четырех еще не открытых элементов с атомными массами 45, 68, 70 и 180. Существование их было предсказано Д. И. Менделеевым.
Закон периодичности и периодическая система элементов сыграли важную конструктивную роль при проверке и уточнении свойств многих элементов. Однако настоящий триумф периодической системы Д. И. Менделеева был связан с открытием предсказанных им элементов. В 1875 г. французский химик П. Лекок де Буабодран, исследуя цинковые руды методами спектрального анализа, обнаружил следы неизвестного элемента. Открытие этого элемента, названного галлием, быть может, прошло бы незаметным, если бы некоторое время спустя автор не получил письмо от русского ученого, в котором утверждалось, что плотность нового элемента должна быть равна не 4,7 г/см3, как сообщал П. Лекок де Буабодран, а 5,9 г/см3. Повторные измерения плотности очищенного от примеси галлия дали значение 5,904 г/см3.
Предсказывая свойства неизвестных элементов, Д. И. Менделеев использовал вытекавшее из периодического закона правило звездности, в соответствии с которым свойства любого химического элемента, например, Mg, находятся в закономерной связи со свойствами соседних элементов, расположенных по горизонтали (Na, Al), вертикали (Be, Ca) и диагонали (Li, Sc и K, B).

Спустя несколько лет шведский ученый Л. Нильсон открыл предсказанный Д.И. Менделеевым экабор, назвав его скандием. Наконец, в 1886 г. немецкий химик К. Винклер открыл новы элемент – германий, свойства которого полностью совпали со свойствами, указанными Д. И. Менделеевым для экасицилия. После этого периодический закон получил всемирное признание, а периодическая система стала неотъемлимой частью любого учебника по химии.
Периодический закон – величайшее достижение химической науки, основа всей современной химии. С его открытием химия перестала быть описательной наукой, в ней стало возможным научное предвидение.
Первый вариант Периодической таблицы элементов был опубликован Дмитрием Ивановичем Менделеевым в 1869 году - задолго до того, как было изучено строение атома.
Более детальное изучение строения вещества показало, что периодичность свойств элементов обусловлена не атомной массой, а электронным строением атомов.
Заряд ядра является характеристикой, определяющей электронное строение атомов, а следовательно, и свойства элементов. Поэтому в современной формулировке Периодический закон звучит так:
свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от порядкового номера (от величины заряда ядра их атомов).
Выражением Периодического закона является периодическая система элементов.
Дата: 2019-04-23, просмотров: 276.